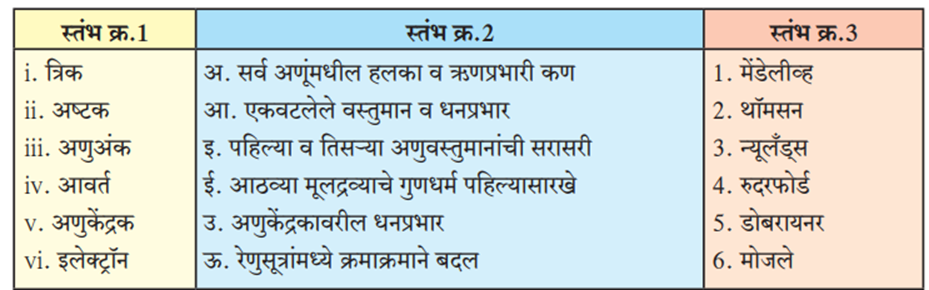
1. स्तंभ क्र. 1 शी जुळेल या प्रकारे स्तंभ क्र. 2 व 3 ची फेरमांडणी करा.

2. योग्य पर्याय निवडून विधान पूर्णलिहा.
अ. अल्क धातूंच्या बाह्यतम कवचातील इलेक्ट्रॉनांची संख्या ………… आहे.
(i) 1 (ii) 2 (iii) 3 (iv) 7
(उत्तर)अल्क धातूंच्या बाह्यतम कवचातील इलेक्ट्रॉनांची संख्या ….. 1……. आहे.
आ. अल्कधर्मी मृदा धातूंची संयुजा 2 आहे. म्हणजे त्यांची आधुनिक आवर्तसारणीतील जागा…………… मध्ये आहे.
(i) गण 2 (ii) गण 16 (iii) आवर्त 2 (iv) डी-खंड
(उत्तर)अल्कधर्मी मृदा धातूंची संयुजा 2 आहे. म्हणजे त्यांची आधुनिक आवर्तसारणीतील जागा…….. गण 2……. मध्ये आहे.
इ. मलूद्रव्य X च्या क्लोराइडचे रेणुसत्र XCl आ हे. हे संयुग उच्च द्रवणाक असलेला स् थायू आहे. X हे मलूद्रव्य आवर्तसारणीच्या ज्या गणात असेल त्या गणात पुढीलपैकी कोणते मलूद्रव्य असेल?
i. Na ii. Mg iii. Al iv. Si
(उत्तर) Na
ई. आधुनिक आवर्तसारणीत अधातू कोणत्या खंडात आहेत?
i. s-खंड ii. p-खंड iii. d-खंड iv. f-खंड
(उत्तर) p-खंड
3. एका मूलद्रव्याचे इलेक्ट्रॉन संरूपण 2,8,2 असे आहे. यावरून खालील प्रश्नांची उत्तरे लिहा.
अ. या मूलद्रव्याचा अणुअंक किती?
(उत्तर) .मूलद्रव्याचा अणुअंक 12 आहे
आ. या मूलद्रव्याचा गण कोणता?
(उत्तर) .या मूलद्रव्याचा गण 2 आहे
इ. हे मूलद्रव्य कोणत्या आवर्तात आहे?
(उत्तर) .हे मूलद्रव्य तिसऱ्या आवर्तात आहे
ई. या मूलद्रव्याचे रासायनिक गुणधर्म खालीलपैकी कोणत्या मूलद्रव्यासारखे असतील? (कंसात अणुअंक दिले आहेत)
N (7), Be (4) , Ar (18), Cl (17)
(उत्तर) .या मूलद्रव्याचे रासायनिक गुणधर्म Be (4) मूलद्रव्यासारखे असतील
4. दिलेल्या अणुअंकांच्या आधारे खालील मूलद्रव्यांचे इलेक्ट्रॉन संरूपण लिहा. त्यावरून प्रश्नांची उत्तरे स्पष्टीकरणासहीत लिहा.
अ. 3 Li, 14Si, 2 He, 11Na, 15 P यांच्यापैकी तिसऱ्या आवर्तातील मूलद्रव्ये कोणती?
| मूलद्रव्य | इलेक्ट्रॉन संरूपण |
| 3 Li | 2,1 |
| 14Si | 2,8,4 |
| 2 He | 2 |
| 11Na | 2,8,1 |
| 15 P | 2,8,5 |
तिसऱ्या आवर्तातील मूलद्रव्ये 14Si , 11Na, 15 P
आ. 1 H, 7 N, 20Ca, 16S, 4 Be, 18 Ar यांच्यापैकी दुसऱ्या गणातील मूलद्रव्ये कोणती?
(उत्तर)
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| 1 H | 1 |
| 7 N | 2,5 |
| 20Ca | 2,8,8,2 |
| 16S | 2,8,6 |
| 4 Be | 2,2 |
| 18 Ar | 2,8,8 |
4Be ,20 Caदुसऱ्या गणातील मूलद्रव्ये आहे
इ. 7 N, 6 C, 8 O, 5 B, 13 Al यांच्यापैकी सर्वाधिक विद्युतऋण मूलद्रव्य कोणते?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| 7N | 2,5 |
| 6C | 2,4 |
| 8 O | 2,6 |
| 5B | 2,3 |
| 13Al | 2,8,3 |
सर्वाधिक विद्युतऋण मूलद्रव्य 8O
ई. 4 Be, 6 C, 8 O, 5 B, 13 Al यांच्यापैकी सर्वाधिक विद्युतधन मूलद्रव्य कोणते?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| 4BE | 2,2 |
| 6C | 2,4 |
| 8 O | 2,6 |
| 5B | 2,3 |
| 13Al | 2,8,3 |
सर्वाधिक विद्युतधन मूलद्रव्य 13Al आहे
उ. 11Na, 15P, 17C1, 14Si, 12Mg यांच्यापैकी सर्वाधिक आकारमान असलेला अणू कोणता?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| (i) 11Na | 2, 8, 1 |
| (ii) 15P | 2, 8, 3 |
| (iii) 17Cl | 2, 8, 7 |
| (iv) 14Si | 2, 8, 4 |
| (v) 12Mg | 2, 8, 2 |
(उत्तर)11NA सर्वाधिक आकारमान असलेला अणू कोणता?
ऊ. 19K, 3 Li, 11Na, 4 Be यांच्यापैकी सर्वात कमी अणुत्रिज्या असलेला अणू कोणता?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| (i) 19K | 2, 8, 8, 1 |
| (ii) 3Li | 2, 1 |
| (iii) 11Na | 2, 8, 1 |
| (iv) 4Be | 2, 2 |
सर्वात कमी अणुत्रिज्या असलेला अणू 4Be आहे
ए. 13A1, 14Si, 11Na, 12Mg, 16 S यांच्यापैकी सर्वाधिक धातु-गुणधर्म असलेले मूलद्रव्य कोणते?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| (i) 13Al | 2, 8, 3 |
| (ii) 14Si | 2, 8, 4 |
| (iii) 11Na | 2, 8, 1 |
| (iv) 12Mg | 2, 8, 2 |
| (v) 16S | 2, 8, 6 |
सर्वाधिक धातु-गुणधर्म असलेले मूलद्रव्य कोणते 11Na आहे
ऐ. 6 C, 3 Li, 9 F, 7 N, 8 O यांच्यापैकी सर्वाधिक अधातु – गुणधर्म असलेले मूलद्रव्य कोणते?
| मूलद्रव्ये | इलेक्ट्रॉन संरूपण |
| (i) 6C | 2, 4 |
| (ii) 3Li | 2, 1 |
| (iii) 9F | 2, 7 |
| (iv) 7N | 2, 5 |
| (v) 8O | 2, 6 |
सर्वाधिक अधातु – गुणधर्म असलेले मूलद्रव्य 9f आहे
5. वर्णनावरून मूलद्रव्याचे नाव व संज्ञा लिहा.
अ. सर्वात लहान आकारमानाचा अणू
(उत्तर) हेलियम सर्वात लहान आकारमानाचा अणू आहे
आ. सर्वात कमी अणुवस्तुमानाचा अणू
सर्वात कमी अणुवस्तुमानाचा अणू हैड्रोजन आहे
इ. सर्वाधिक विद्युतऋण अणू
सर्वाधिक विद्युतऋण अणू फ्ल्युओरीने आहे
ई. सर्वात कमी अणुत्रिज्या असलेला राजवायू
सर्वात कमी अणुत्रिज्या असलेला राजवायू हेलियम आहे
उ. सर्वाधिक अभिक्रियाशील अधातू
सर्वाधिक अभिक्रियाशील अधातू फ्ल्युओरीने आहे
6. थोडक्यात टिपा लिहा.
(उत्तर) .जेव्हा घटक त्यांच्या वाढत्या अणू वस्तुमानाच्या क्रमाने मांडले जातात, तेव्हा मेंडेलीव्हला आढळले की समान भौतिक आणि रासायनिक गुणधर्म असलेले घटक निश्चित अंतरानंतर पुनरावृत्ती करतात. या निष्कर्षांच्या आधारे मेंडेलीव्हने नियतकालिक कायदा सांगितला. घटकांचे भौतिक आणि रासायनिक गुणधर्म हे त्यांच्या अणू वस्तुमानाचे नियतकालिक कार्य आहेत.
आ. आधुनिक आवर्तसारणीची रचना
. मेंडेलीव्हचा आवर्ती नियम
(उत्तर) .आधुनिक आवर्तसारणीमध्ये सात आडव्या ओळी आहेत, त्या म्हणजेच 1 ते 7 आवर्त. तसेच या सारणीतील अठरा उभे स्तंभ म्हणजेच 1 ते 18 गण होत. आवर्त व गण यांच्या रचनेतून चौकटी तयार होतात. या चौकटींमध्ये वरच्या बाजूला ओळीने अणुअंक दर्शवलेले असतात. प्रत्येक चौकट ही एका मूलद्रव्याची जागा आहे.
सात ओळींव्यतिरिक्त अावर्तसारणीच्या तळाशी आणखी दोन ओळी स्वतंत्रपणे दाखविलेल्या आहेत. त्यांना अनुक्रमे लॅन्थॅनाइड श्रेणी आणि अॅक्टिनाइड श्रेणी असे म्हणतात. दोन श्रेणींसहित आवर्तसारणीमध्ये 118 चौकटी आहेत.
म्हणजेच आधुनिक आवर्तसारणीमध्ये 118 मूलद्रव्यांसाठी जागा आहेत. अगदी अलीकडच्या काळात काही मूलद्रव्यांची निर्मिती प्रयोगसिद्ध झाल्यामुळे आता ही अावर्तसारणी पूर्ण भरली आहे व सर्व 118 मूलद्रव्ये आता शोधली गेली आहेत.
संपूर्ण आवर्तसारणी एस्-खंड, पी-खंड, डी-खंड व एफ्-खंड अशा चार खंडांमध्ये विभागली आहे. एस्-खंड हा गण 1 व 2 यांचा बनलेला आहे . गण 13 ते गण 18 हे पी-खंडामध्येयेतात. गण 3 ते गण 12 म्हणजे डी-खंड तर तळाच्या लॅन्थॅनाइड आणि अॅक्टिनाइड श्रेणी म्हणजे एफ्-खंड होय.
डी-खंडातील मूलद्रव्यांना संक्रमक मूलद्रव्ये म्हणतात. आवर्तसारणीच्या पी-खंडामध्ये एक नागमोडी रेषा दर्शविता येते. या नागमोडी रेषेच्या साहाय्याने मूलद्रव्यांचे पारंपरिक तीन प्रकार आधुनिक अावर्तसारणीमध्ये स्पष्टपणे दाखविता येतात. नागमोडी रेषेच्या किनारीने धातुसदृश मूलद्रव्ये आहेत. नागमोडी रेषेच्या डाव्या बाजूला सर्व धातू असून उजव्या बाजूला सर्व अधातू आहेत.
ई. समस्थानकांचे मेंडेलीव्हच्या व आधुनिक आवर्तसारणीतील स्थान
. मेंडेलीव्हचा आवर्ती नियम
(उत्तर) .मेंडेलेवाने आवर्तसारणी अजिबात उत्तरीत केल्यानंतर अनेक वर्षांनी इसोटोप आविष्कार केले. इसोटोप्सच्या आणखी केमिकल गुणस्थली असतात पण त्यांच्या आणखी आणुसंख्या वेगळी असते. इसोटोप्सना मेंडेलेवाच्या आवर्तसारणीमध्ये ठेवण्याचा एक कठीण समस्या उद्भवला. मोसेलीने आणखी गुणस्थली असलेली आणुसंख्या ही एक मौलिक गुणस्थली म्हणून ठरविली की आणुसंख्येमुळे एका आणुच्या तत्वाची मौळिक विशेषता होते अशी संधी लागली.
आधुनिक आवर्तसारणीत, आणुसंख्यांच्या वेगळ्या वाढीच्या क्रमानुसार, एका विशिष्ट तत्वाच्या इसोटोप्ससाठी मेंडेलेवाच्या आवर्तसारणीत दिसणाऱ्या कोणत्याही त्रुटी किंवा विसंगती समस्या समाधान केली जाते. 17Cl35 आणि 17Cl37 या इसोटोप्सचा समान आणुसंख्या असल्याने ते आवर्तणसाठी समान गटात ठेवले गेले.
7. शास्त्रीय कारणे लिहा.
अ. आवर्तामध्ये डावीकडून उजवीकडे जाताना अणुत्रिज्या कमी होत जाते.
इलेक्ट्रॉन दिल्याने धनप्रभारीत आयन तयार होतात धातूमध्ये इलेक्ट्रॉन देण्याची प्रवृत्ती अस्तेय यालाच धातुगून म्हणतात
एका आवर्तामध्ये डावीकडून उजवीकडे जाताना, बाह्यतम कवच तेच राहते आणि इलेक्ट्रॉनची संख्या वाढत जाते. केंद्रकावरील धनप्रभार वाढत जातो आणि अणुत्रिज्या कमी होत जाते. यामुळे, प्रयुक्त होणारा परिणामी केंद्रकीय प्रभार वाढतो आणि संयुजा-इलेक्ट्रॉन गमावण्याची प्रवृत्ती कमी कमी होत जाते. म्हणजेच, आवर्तामध्ये डावीकडून उजवीकडे जाताना, मूलद्रव्यांचा धातु-गुणधर्म कमी कमी होत जातो.
आ. आवर्तामध्ये डावीकडून उजवीकडे जाताना धातु-गुणधर्म कमी होत जातो.
धातू हे असे मूलद्रव्य आहेत ज्यांच्यामध्ये इलेक्ट्रॉन देण्याची प्रवृत्ती असते. जेव्हा धातू इलेक्ट्रॉन देतात तेव्हा ते धन प्रभारित आयन बनतात. या प्रवृत्तीलाच धातूगुण म्हणतात.
आवर्तामध्ये डावीकडून उजवीकडे जाताना,
- बाह्यतम कवच तेच राहते: प्रत्येक स्तंभात समान संख्या बाह्यतम कवच इलेक्ट्रॉन असतात.
- इलेक्ट्रॉनची संख्या वाढते: प्रत्येक नवीन स्तंभात, एक नवीन इलेक्ट्रॉन बाह्यतम कवचात भरले जाते.
- केंद्रकावरील धनप्रभार वाढतो: प्रोटॉनची संख्या वाढत असल्यामुळे केंद्रकावरील धनप्रभार वाढतो.
- अणुत्रिज्या कमी होते: इलेक्ट्रॉनची संख्या वाढत असल्यामुळे इलेक्ट्रॉन आणि केंद्रक यांच्यातील आकर्षण वाढते आणि अणुत्रिज्या कमी होते.
या बदलांमुळे,
- प्रयुक्त होणारा परिणामी केंद्रकीय प्रभार वाढतो: केंद्रकावरील धनप्रभार वाढतो आणि अणुत्रिज्या कमी होते, त्यामुळे इलेक्ट्रॉनवर केंद्रकाचा आकर्षण वाढतो.
- संयुजा-इलेक्ट्रॉन गमावण्याची प्रवृत्ती कमी होते: वाढत्या परिणामी केंद्रकीय प्रभावामुळे इलेक्ट्रॉन गमावणे कठीण होते.
- धातुगुण कमी कमी होत जातात: धातुगुण हे इलेक्ट्रॉन गमावण्याच्या प्रवृत्तीवर अवलंबून असतात. इलेक्ट्रॉन गमावण्याची प्रवृत्ती कमी होत असल्यामुळे धातुगुण कमी कमी होत जातात.
इ. गणामध्ये वरून खाली जाताना अणुत्रिज्या वाढत जाते.
अणूची त्रिज्या हे अणूच्या केंद्रकापासून सर्वात बाहेरील कक्षेतील इलेक्ट्रॉनपर्यंतचे अंतर आहे. हे अंतर पिकोमीटर (pm) मध्ये मोजले जाते.
आवर्त सारणीमध्ये, गण हे स्तंभ दर्शवतात. गणात वरून खाली जाताना,
- नवीन कवचाची भर पडते: प्रत्येक नवीन गणात, एक नवीन इलेक्ट्रॉन कवच भरले जाते.
- अणुकेंद्रक आणि संयुजा-इलेक्ट्रॉन यांच्यातील अंतर वाढते: नवीन कवचामुळे, इलेक्ट्रॉन आणि केंद्रका यांच्यातील अंतर वाढते.
- परिणामी केंद्रकीय प्रभार कमी होतो: इलेक्ट्रॉन आणि केंद्रकामधील अंतर वाढल्याने, केंद्रकाचा इलेक्ट्रॉनवरील आकर्षण कमी होते.
- संयुजा-इलेक्ट्रॉनवरील आकर्षणबल कमी होते: कमी केंद्रकीय प्रभावामुळे, इलेक्ट्रॉनवर केंद्रकाचे आकर्षण कमी होते.
या सर्व कारणांमुळे, गणात वरून खाली जाताना अणूची त्रिज्या आणि आकारमान वाढते.
उदाहरणे:
- लिथियम (Li): यात एक कवच आणि एक इलेक्ट्रॉन आहे. त्यामुळे, त्याची त्रिज्या आणि आकार लहान आहे.
- फ्रान्सियम (Fr): यात सात कवच आणि 87 इलेक्ट्रॉन आहेत. त्यामुळे, त्याची त्रिज्या आणि आकार लिथियमपेक्षा मोठा आहे.
निष्कर्ष: गणात वरून खाली जाताना, अणूची त्रिज्या आणि आकारमान वाढते.
ई. एकाच गणामधील मूलद्रव्यांची संयुजा समान असते.
संयुजा ही मूलद्रव्याची रासायनिक बंध निर्माण करण्याची क्षमता दर्शवते.मूलद्रव्याची संयुजा त्यांच्या बाह्यतम कक्षेतील इलेक्ट्रॉन, ज्यांना संयुजा-इलेक्ट्रॉन म्हणतात, यांच्यावरून ठरवली जाते.
- इलेक्ट्रॉन गमावणे: जर एखाद्या मूलद्रव्यात कमी संयुजा-इलेक्ट्रॉन असतील तर ते इलेक्ट्रॉन गमावून धनायन बनण्याची प्रवृत्ती दर्शवतात.
- इलेक्ट्रॉन ग्रहण करणे: जर एखाद्या मूलद्रव्यात जास्त संयुजा-इलेक्ट्रॉन असतील तर ते इलेक्ट्रॉन ग्रहण करून ऋणायन बनण्याची प्रवृत्ती दर्शवतात.
एकाच गणातील सर्व मूलद्रव्यांची बाह्यतम कक्षेतील इलेक्ट्रॉनची संख्या समान असते. त्यामुळे, ते समान रासायनिक बंध निर्माण करण्याची प्रवृत्ती दर्शवतात आणि समान संयुजा दर्शवतात.
उदाहरणे:
- गण 1: यातील सर्व मूलद्रव्यांच्या बाह्यतम कक्षेत 1 इलेक्ट्रॉन असतो. त्यामुळे, ते 1 इलेक्ट्रॉन गमावून धनायन बनतात आणि त्यांची संयुजा +1 असते.
- गण 17: यातील सर्व मूलद्रव्यांच्या बाह्यतम कक्षेत 7 इलेक्ट्रॉन असतात. त्यामुळे, ते 1 इलेक्ट्रॉन ग्रहण करून ऋणायन बनतात आणि त्यांची संयुजा -1 असते.
निष्कर्ष:
- बाह्यतम इलेक्ट्रॉन हे मूलद्रव्याची संयुजा ठरवण्यात महत्त्वपूर्ण भूमिका बजावतात.
- एकाच गणातील मूलद्रव्यांची बाह्यतम कक्षेतील इलेक्ट्रॉनची संख्या समान असल्यामुळे ते समान संयुजा दर्शवतात.
उ. तिसऱ्या कवचाची इलेक्ट्रॉन धारकता 18 असूनही तिसऱ्या आवर्तामध्ये फक्त आठ मूलद्रव्ये आहेत.
आवर्तसारणीच्या तिसऱ्या रांगेत ८ मूलद्रव्ये आहेत (Na, Mg, Al ते Ar). ही संख्या इलेक्ट्रॉन भरती आणि अष्टक नियमावर आधारित. त्यांच्या बाहेरील कक्षेत २ किंवा ८ इलेक्ट्रॉन असतात. यामुळे त्यांचे गुणधर्म आणि रासायनिक वर्तन समजण्यासाठी इलेक्ट्रॉन विन्यास महत्त्वपूर्ण आहे.
तिसऱ्या आवर्तात डावीकडून उजवीकडे अणुक्रमांक आणि इलेक्ट्रॉनची संख्या वाढते. इलेक्ट्रॉन अष्टक पूर्ण करण्यासाठी 8 मूलद्रव्ये (Na ते Ar) असतात. इलेक्ट्रॉन विन्यास आणि अष्टक नियम हे गुणधर्म आणि रासायनिक वर्तन समजण्यासाठी महत्त्वपूर्ण आहे.
| अणुअंक | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 |
| मूलद्रवे | Na | Mg | A1 | Si | P | S | C1 | Ar |
अरगॉन (Ar) हे तिसऱ्या आवर्तातील शेवटचे मूलद्रव्य आहे. यात इलेक्ट्रॉनचे अष्टक पूर्ण असल्याने ते स्थिर आहे. इतर मूलद्रव्ये अष्टक पूर्ण करण्यासाठी Ar शी प्रतिक्रिया देतात. अष्टक नियमामुळे तिसऱ्या आवर्तात ८ मूलद्रव्ये असतात.
प्रश्न 4.दिलेल्या वर्णनावरून नावे लिहा.
अ. K, L व M ह्या कवचांमध्ये इलेक्ट्रॉन असलेला आवर्त.
(उत्तर).K, L व M ह्या कवचांमध्ये इलेक्ट्रॉन असलेला आवर्त तिसरा आहे.
आ. शून्य संयुजा असलेला गण
(उत्तर). शून्य संयुजा असलेला गण 18 आहे.
इ. संयुजा 1 असलेल्या अधातूंचे कुल
(उत्तर). 1 संयुजा असलेल्या अधातूंचे कुल हॅलोजन कुल आहे.
ई. संयुजा 1 असलेल्या धातूंचे कुल
(उत्तर). संयुजा 1 असलेल्या धातूंचे कुल गण 1.
उ. संयुजा 2 असलेल्या धातूंचे कुल
(उत्तर). संयुजा 2 असलेल्या धातूंचे कुल गण 2.
ऊ. दुसऱ्या व तिसऱ्या आवर्तांमधील धातुसदृश
(उत्तर). दुसऱ्या व तिसऱ्या आवर्तांमधील धातुसदृश बोरॉन व सिलिकॉन
ए. तिसऱ्या आवर्तामधील अधातू
(उत्तर). फॉस्फोरस ,सल्फर ,क्लोरीन आणि आर्गॉन हि सर्व मूलद्रवे आहे
ऐ. संयुजा 4 असलेली दोन मूलद्रव्ये
(उत्तर). संयुजा 4 असलेली दोन मूलद्रव्ये सिलिकॉन व कार्बन आहे.