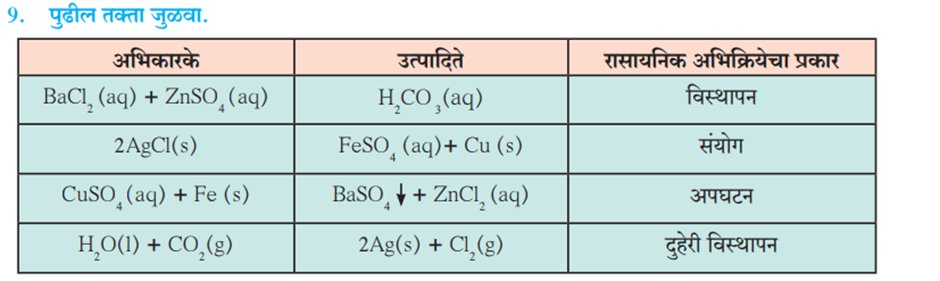
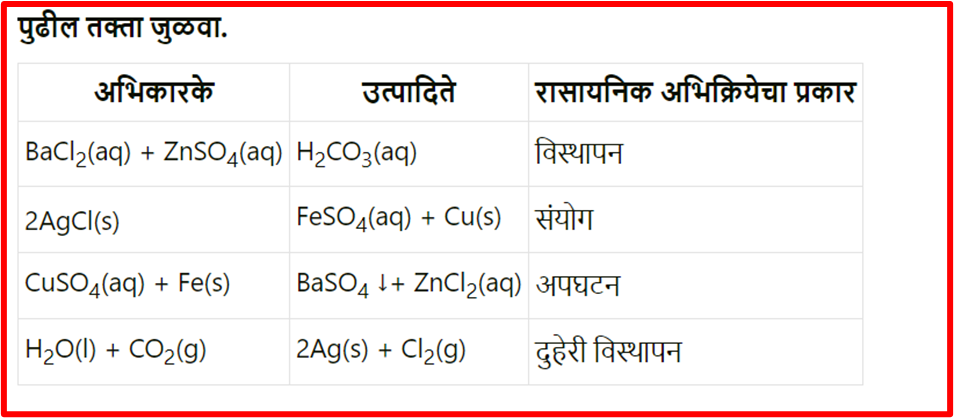
1. दिलेल्या विधानांतील रिकाम्या जागी कंसातील योग्य पर्याय निवडून विधाने सकारण स्पष्ट करा. (ऑक्सिडीकरण, विघटन, विस्थापन, विद्युत अपघटन, क्षपण, जस्त, तांबे, दुहेरी विस्थापन)
अ. लोखंडाचे पत्रे गंजू नयेत म्हणून त्यांच्यावर .. जस्त……धातूचा थर दिला जातो.
(उत्तर). लोखंडाची गंज रोखण्यासाठी लोखंडच्या पत्र्यांवर जस्त चा थर चढविला जातो लोखंडाची गंज ही ऑक्सिडेशनची प्रक्रिया आहे. यामुळे लोखंडावर लालसर पदार्थ (Fe2O3.H2O) जमा होतो. यालाच गंज म्हणतात. गंज रोखण्यासाठी लोखंडाच्या पत्र्यांवर जस्तेचा थर (जस्तीकरण) चढविला जातो.
आ. फेरस सल्फेटचे फेरिक सल्पेटमध्ये रूपांतर ही एक ऑक्सिडीकरण अभिक्रिया आहे.
(उत्तर). लोखंडाचे (Fe²⁺) द्विसंयुजीय आयॉन एक इलेक्ट्रॉन गमावून लोहाचे (Fe³⁺) त्रिसंयुजीय आयॉन बनते. या प्रक्रियेला ऑक्सीकरण म्हणतात. लोखंडाच्या गंजेमध्ये असाच बदल होतो.
इ. आम्लयुक्त पाण्यातून विद्युतप्रवाह जाऊ दिल्यास पाण्याचे ..विद्युत अपघटन होते.
(उत्तर). विजेचा प्रवाह आम्लयुक्त पाण्यातून (acidulated water) वाहवताना पाण्याचे विघटन (decomposition) होते. या प्रक्रियेत हायड्रोजन आणि ऑक्सिजन वायू तयार होतात. विजेच्या मदतीने पाण्याचे हे विघटन होते म्हणून त्याला विद्युत-विघटन (electrolytic decomposition) असे म्हणतात.
ई. BaCl 2 च्या जलीय द्रावणात ZnSO 4 जलीय द्रावण मिसळले असता पांढरा अवक्षेप तयार होणे हे दुहेरी विस्थापन अभिक्रियेचे उदाहरण आहे.
(उत्तर).जस्त सल्फेट (ZnSO₄) च्या जलीय द्रव्य आणि बेरियम क्लोराइड (BaCl₂) च्या जलीय द्रव्य मिश्र केल्यावर, एक द्वि-विस्थापन अभिक्रिया (double displacement reaction) होते. यामध्ये, दोन्ही मीठांमधील आयन्स (ions) एकमेकांशी विनिमय करून घेऊन नवीन संयुगे तयार होतात. उदाहरणार्थ, या अभिक्रियेमुळे जस्त क्लोराइड (ZnCl₂) आणिबेरियम सल्फेट (BaSO₄) तयार होतात.
2. पुढील प्रश्नांची उत्तरे लिहा.
अ. दिलेल्या अभिक्रियेत जेव्हा एकाच वेळी ऑक्सिडीकरण व क्षपण अभिक्रिया घडून येतात तेव्हा त्या अभिक्रियेला काय म्हणतात? एका उदाहरणाच्या साहाय्याने स्पष्ट करा.
(उत्तर). जेव्हा एकाच वेळी ऑक्सिडीकरण आणि क्षपण या दोन्ही रासायनिक अभिक्रिया घडतात तेव्हा त्याला रेडॉक्स अभिक्रिया म्हणतात.
रेडॉक्स अभिक्रिया:
• क्षपण > ऑक्सिडीकरण
• एका अभिक्रियाकारकाचे ऑक्सिडीकरण होते, तर दुसऱ्याचे क्षपण होते.
• ऑक्सिडक क्षपणकाला ऑक्सिडीकरण करते आणि क्षपणक ऑक्सिडकला क्षपण करते.
उदाहरण:
• MgO + H₂ → Mg + H₂O
या अभिक्रियेमध्ये, मॅग्नेशियम ऑक्साइड (MgO) मधील ऑक्सिजन क्षपण होते आणि हायड्रोजन (H₂) ऑक्सिडीकरण होते.
रेडॉक्स अभिक्रियेची उदाहरणे:
• मॅग्नेशियम डायऑक्साइड आणि हायड्रोक्लोरिक ऍसिड मधून मॅग्नेशियम क्लोराईड आणि पाणी तयार होणे.
• लोखंड आणि जस्त सल्फेट मधून लोखंड सल्फेट आणि जस्त तयार होणे.
• द्रावणात कॉपर सल्फेट आणि सोडियम हायड्रॉक्साइड मधून कॉपर हायड्रॉक्साइड आणि सोडियम सल्फेट तयार होणे.
रेडॉक्स अभिक्रिया अनेक रासायनिक प्रक्रियांमध्ये महत्त्वाची भूमिका बजावतात, जसे की दहन, श्वसन आणि बॅटरी रसायनशास्त्र.
आ. हायड्रोजन पेरॉक्साइडचे अपघटन ह्या रासायनिक अभिक्रियेचा दर कसा वाढविता येतो?
(उत्तर). खोलीच्या तापमानावर, हायड्रोजन पेरोक्साइड (H₂O₂) हे पाणी (H₂O) आणि ऑक्सिजन (O₂) मध्ये हळूहळू विघटित होते. मात्र, याच अभिक्रियेला गती देण्यासाठी जर मॅंगॅनीज डायऑक्साइड (MnO₂) चा पावडर हायड्रोजन पेरोक्साइडमध्ये मिसवला तर हीच प्रक्रिया वेगाने होते.
इ. ऑक्सीजन व हायड्रोजन यांचा संदर्भ घेऊन अभिक्रियांचे कोणते प्रकार पडतात ते उदाहरणासहित लिहा.
(उत्तर). ऑक्सिजन आणि हायड्रोजन यांच्याशी संबंधित दोन प्रकारच्या प्रमुख अभिक्रिया आहेत:
१. ऑक्सिडीकरण अभिक्रिया:
ऑक्सिडीकरण अभिक्रियेत एखाद्या पदार्थामध्ये ऑक्सिजनचे अणू (O) सामील होते किंवा त्यापासून हायड्रोजनचे अणू (H) बाहेर पडतात. यामुळे त्या पदार्थाची ऑक्सिडेशन संख्या वाढते.
उदाहरण:
• कार्बनचे दहन: वातावरणातील ऑक्सिजनसोबत कार्बनची (C) अभिक्रिया होऊन कार्बन डायऑक्साइड (CO₂) तयार होते. या प्रक्रियेत कार्बन ऑक्सिजन अणू स्वीकारते, म्हणून ही ऑक्सिडीकरण अभिक्रिया आहे.
(रिडक्शन) अभिक्रिया
अभिक्रियेत एखाद्या पदार्थामध्ये हायड्रोजनचे अणू (H) सामील होतात किंवा त्यापासून ऑक्सिजनचे अणू (O) बाहेर पडतात. यामुळे त्या पदार्थाची ऑक्सिडेशन संख्या कमी होते.खालील उदाहरणे नंतरच्या चरणात समाविष्ट केल्या जाऊ शकतात:
- लोह (Fe) आणि गंधक (S) ची अभिक्रिया होऊन फेरस सल्फाइड (FeS) तयार होते. या अभिक्रियेत लोह ऑक्सिजन अणू गमावते, म्हणून ही ऑक्सिडीकरण अभिक्रिया आहे.
ई.. अभिकारक व उत्पादित म्हणजे काय ते सोदाहरण लिहा.
रासायनिक अभिक्रियेत जे पदार्थ बंध तोडून सहभागी होते त्यांना अभिक्रियाकारक (Reactant) म्हणतात.रासायनिक अभिक्रियेनंतर नवीन बंध तयार होऊन जे पदार्थ तयार होते त्यांना उत्पादने (Product) म्हणतात उदाहरण: हवेमध्ये कोळसा (कार्बन) जाळल्यानंतर कार्बन डायऑक्साइड वायू तयार होतो. या अभिक्रियेत कोळसा (कार्बन) आणि हवेमधील ऑक्सिजन हे अभिक्रियाकारक आहेत, तर कार्बन डायऑक्साइड हे उत्पादन आहे.
उ. NaOH पाण्यात मिसळणे व CaO पाण्यात मिसळणे या देान घटनांमधील साम्य व भेद लिहा
साम्यता:
• सोडियम हायड्रॉक्साइड (NaOH) आणि कॅल्शियम ऑक्साइड (CaO) दोन्ही पाण्यात वेगळेपणे विरघळवल्या जातात तेव्हा, उष्णता बाहेर पडते, ज्यामुळे तापमान वाढते. ही अभिक्रिया उष्णता उत्सर्जक (exothermic) आहे.
• दोन्ही प्रतिक्रिया संयोग (combination) प्रतिक्रिया आहेत आणि एकच उत्पादन (single product) तयार होते.
रासायनिक समीकरणे:
• NaOH(s) + H2O → NaOH(aq) + उष्णता (Heat)
• CaO(s) + H2O → Ca(OH)2(aq) + उष्णता (Heat)
भेद:
• सोडियम हायड्रॉक्साइड (NaOH) चा जलीय द्रावण हा मजबूत क्षार (strong alkali) मानला जातो.
• कॅल्शियम हायड्रॉक्साइड (Ca(OH)2) चा जलीय द्रावण हा कमजोर क्षार (weak alkali) मानला जातो.
3. खालीलसंज्ञाउदाहरणांसहितस्पष्टकरा.
(उत्तर). उष्माग्राही अभिक्रिया ही ऊष्मा शोषून घेणारी अभिक्रिया आहे. पाण्यात विरघळताना काही पदार्थ उष्णता (ऊष्मा) बाहेरील वातावरणातून शोषून घेतात, त्यामुळे द्रावणाचे तापमान कमी होते. उदाहरणार्थ, NH₄Cl पाण्यात विरघळणे ही उष्माग्राही अभिक्रिया आहे.
आ. संयोग अभिक्रिया
(उत्तर). संयोग अभिक्रिया म्हणजे दोन किंवा अधिक भिन्न पदार्थ एकत्र येऊन एखादा एकमेव नवीन पदार्थ तयार करण्याची रासायनिक प्रक्रिया. जसे, लोह + गंधक → लोह सल्फाइड, किंवा हायड्रोजन + ऑक्सिजन → पाणी.
इ. संतुलित समीकरण
(उत्तर). संतुलित समीकरण ही रासायनिक अभिक्रियेचे प्रमाणात्मक प्रतिनिधित्व असते. त्यात अभिक्रियाकारक (Reactants) आणि उत्पादनांची (Products) संख्या समान असते. हे समीकरण अभिक्रियेदरम्यान सहभागी असलेल्या प्रत्येक घटकांच्या (अणू किंवा आयन्स) संतुलित संख्येचे प्रतिनिधित्व करते.
ई. विस्थापन अभिक्रिया
(उत्तर). विस्थापन अभिक्रिया ही अशी रासायनिक प्रक्रिया आहे ज्यामध्ये एखाद्या संयुगातील अणू किंवा गट दुसऱ्या अणू किंवा गटाने विस्थापित केले जाते. यामध्ये, अधिक क्रियाशील अणू किंवा गट कमी क्रियाशील अणू किंवा गटाची जागा घेतो. उदाहरणार्थ, Zn + CuSO₄ → ZnSO₄ + Cu.
4. शास्त्रीय कारणे लिहा.
अ. चुनखडी तापवून मिळालेला वायू ताज्या चुन्याच्या निवळीतून जाऊ दिल्यास निवळी दुधाळ होते.
(उत्तर). चुनखडी तापवून मिळालेला वायू कार्बन डायऑक्साइड (CO₂) आहे. हा वायू ताज्या चुन्याच्या निवळीतून जाऊ दिल्यास निवळी दुधाळ होते कारण:
- रासायनिक अभिक्रिया: CO₂ आणि Ca(OH)₂ (ताजी चुन्याची निवळ) यांच्यामध्ये रासायनिक अभिक्रिया होते.
- कॅल्शियम कार्बोनेट तयार: या अभिक्रियेमुळे कॅल्शियम कार्बोनेट (CaCO₃) नावाचा पांढरा, अद्राव्य पदार्थ तयार होतो.
- दुधाळपणा: CaCO₃ पाण्यात मिसळून सस्पेंशन तयार करतो, ज्यामुळे निवळी दुधाळ दिसते.
समीकरण:
CO₂ + Ca(OH)₂ → CaCO₃ + H₂O
आ. शहाबादी फरशीचे तुकडे HCl मध्ये नाहीसे व्हावयास वेळ लागते पण फरशीचा चुरा मात्र लवकर नाहीसा होतो.
(उत्तर). शहाबादी फरशीचे तुकडे HCl मध्ये विरघळण्यास वेळ लागण्याची कारणे:
- घनता: फरशीचे तुकडे घन असल्यामुळे HCl मध्ये विरघळण्यासाठी त्यांना वेळ लागतो.
- पृष्ठभागाचे क्षेत्रफळ: तुकड्यांचे पृष्ठभागाचे क्षेत्रफळ कमी असल्यामुळे HCl त्यांच्याशी संपर्क साधण्यास वेळ लागतो.
- संघटन: फरशीमध्ये असलेले खनिज HCl मध्ये विरघळण्यास वेळ घेतात.
फरशीचा चुरा लवकर विरघळण्याची कारणे:
- पृष्ठभागाचे क्षेत्रफळ: चुर्याचे पृष्ठभागाचे क्षेत्रफळ मोठे असल्यामुळे HCl त्याच्याशी लवकर संपर्क साधू शकतो.
- घनता: चुरा कमी घन असल्यामुळे HCl मध्ये लवकर विरघळू शकतो.
- संघटन: चुर्यामध्ये असलेले खनिज HCl मध्ये लवकर विरघळण्यास प्रवृत्त असतात.
निष्कर्ष:
फरशीचे तुकडे HCl मध्ये विरघळण्यास वेळ लागतो कारण ते घन असतात, त्यांचे पृष्ठभागाचे क्षेत्रफळ कमी असते आणि त्यातील खनिज HCl मध्ये विरघळण्यास वेळ घेतात.
फरशीचा चुरा लवकर विरघळतो कारण त्याचे पृष्ठभागाचे क्षेत्रफळ मोठे असते, तो कमी घन असतो आणि त्यातील खनिज HCl मध्ये लवकर विरघळण्यास प्रवृत्त असतात.
इ. प्रयोगशाळेत संहत सल्फ्यूरिक आम्लापासून विरल आम्ल तयार करताना पाण्यामध्ये संहत सल्फ्युरिक आम्ल संथ धारेने सोडून द्रावण काचकांडीने हलवीत राहतात.
(उत्तर). प्रयोगशाळेत विरल सल्फ्यूरिक आम्ल तयार करण्याची पद्धत:
1. सुरक्षा: सुरक्षेसाठी, प्रयोगशाळेतील चष्मा, हातमोजे आणि एप्रन घालणे आवश्यक आहे.
2. पाणी थंड करणे: काचेच्या भांड्यात थंड पाणी घ्या आणि ते बर्फाच्या सान्निध्यात ठेवून थंड करा.
3. आम्ल मिसळणे: हळूहळू आणि काळजीपूर्वक संहत सल्फ्यूरिक आम्ल थंड पाण्यात संथ धारेने सोडा.
4. मिश्रण हलवणे: द्रावण काचकांडीने हलवत रहा जेणेकरून आम्ल आणि पाणी पूर्णपणे मिसळतील.
विरल आम्ल तयार करण्याची कारणे:
1. उष्णता: संहत सल्फ्यूरिक आम्ल पाण्यात मिसळताना मोठ्या प्रमाणात उष्णता निर्माण होते.
2. पाण्यात मिसळणे: थंड पाणी आणि संथ धारा यामुळे उष्णता नियंत्रित राहते आणि आम्ल पाण्यात पूर्णपणे मिसळू शकते.
3. सुरक्षा: हळूहळू आम्ल मिसळणे आणि द्रावण हलवणे हे सुरक्षिततेसाठी आवश्यक आहे.
निष्कर्ष:प्रयोगशाळेत विरल सल्फ्यूरिक आम्ल तयार करताना, सुरक्षा आणि उष्णता नियंत्रण हे दोन महत्वाचे घटक आहेत. थंड पाणी, संथ धारा आणि द्रावण हलवणे यामुळे सुरक्षित आणि प्रभावी मिश्रण तयार होते.
ई. खाद्यतेल दीर्घकाळ साठविण्यासाठी हवाबंद डबा वापरणे योग्य ठरते.
(उत्तर). खाद्यतेल दीर्घकाळ साठविण्यासाठी हवाबंद डबा वापरणे योग्य ठरते कारण:
1.ऑक्सिडीकरण टाळणे: हवेतील ऑक्सिजन खाद्यतेलाशी प्रतिक्रिया देऊन ते खराब करते आणि त्याला खवट चव येते. हवाबंद डबा हवा आणि तेल यांच्यातील संपर्क टाळतो.
2.प्रकाश टाळणे: सूर्यप्रकाश खाद्यतेलातील व्हिटॅमिन आणि इतर पोषक घटक नष्ट करू शकतो. हवाबंद डबा प्रकाश टाळण्यास मदत करते.
3.दूषित होणे टाळणे: हवाबंद डबा धूळ, कीटक आणि इतर दूषित घटकांपासून खाद्यतेल सुरक्षित ठेवते.
4.वाष्पीभवन टाळणे: हवाबंद डबा तेलाचे वाष्पीभवन टाळतो.
टिपा:
• तेल एका थंड, कोरड्या ठिकाणी ठेवा.
• तेलाचा वापर करण्यापूर्वी तारखेची तपासणी करा.
• तेल गंध आणि चव यांनी तपासा. जर ते खवट असेल तर ते टाकून द्या.
निष्कर्ष:
हवाबंद डबा खाद्यतेल दीर्घकाळ चांगल्या स्थितीत ठेवण्याचा उत्तम मार्ग आहे.
5. पुढील चित्राचे निरीक्षण करा, रासायनिक अभिक्रिया स्पष्टीकरणासह मांडा.
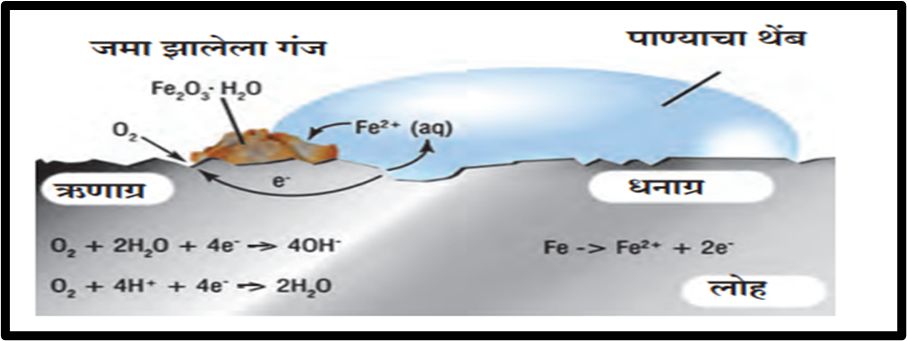
(उत्तर). लोहाचे गंज येणे ही ऑक्सिडीकरणाची प्रक्रिया आहे. लोहावर गंज हे ऑक्सिजन आणि लोहाच्या पृष्ठभागातील साध्या प्रतिक्रियेने तयार होत नाही, तर हे विद्युत-रासायनिक अभिक्रियेने तयार होते. यामध्ये लोह (Fe) हे लोहाचे ऑक्साइड (Fe₂O₃) मध्ये ऑक्सिडीकृत होते. लोहाच्या एका भागावर पाणी (H₂O) हायड्रोजन (H₂) मध्ये कमी होते, तर दुसऱ्या भागावर ऑक्सिजन (O₂) पाण्यात (H₂O) कमी होते. लोहाच्या पृष्ठभागावर वेगवेगळे भाग ॲनोड (anode) आणि कॅथोड (cathode) बनतात.
(१) ॲनोड भागात लोह (Fe) लोह आयन (Fe²⁺) मध्ये ऑक्सिडीकृत होते.
Fe(s) → Fe²⁺(aq) + 2e⁻
(२) कॅथोड भागात ऑक्सिजन (O₂) हायड्रोजन आयन्स (H⁺) आणि इलेक्ट्रॉन्स (e⁻) सोबत मिळून पाण्यात (H₂O) कमी होते.
O₂(g) + 4H⁺(aq) + 4e⁻ → 2H₂O(l)
जेव्हा Fe²⁺ आयन्स ॲनोड भागातून कॅथोड भागात जातात तेव्हा ते पाण्यासोबत प्रतिक्रिया करून पुढे लोह(III) आयन्स (Fe³⁺) मध्ये ऑक्सिडीकृत होतात.
लोह(III) आयन्स पासून लाल रंगाचा हायड्रेटेड ऑक्साइड तयार होतो. यालाच गंज म्हणतात. तो लोहाच्या पृष्ठभागावर जमा होतो.
2Fe³⁺(aq) + 4H₂O(l) → Fe₂O₃.H₂O(s) + 6H⁺(aq)
हवेतील असलेल्या विविध घटकांमुळे धातूंचे ऑक्सिडीकरण होते, त्यामुळे त्यांचे नुकसान होते. यालाच ‘क्षार क्षरण’ (corrosion) म्हणतात. लोहाला गंज येतो आणि त्यावर लाल रंगाचा थर तयार होतो. हे लोहाचे क्षार क्षरण आहे.
6. खालील रासायनिक अभिक्रियेमधील कोणत्या अभिकारकाचे ऑक्सिडीकरण आणि क्षपण होते ते ओळखा.
अ. Fe + S FeS
(उत्तर). या अभिक्रियेत लोह (Fe) क्षपण होऊन सल्फर (S) ऑक्सिडीकरण होते.
आ.2Ag2 O → 4 Ag + O
(उत्तर). ही रासायनिक अभिक्रिया विघटन (decomposition) प्रक्रिया आहे. यामध्ये, सिल्व्हर ऑक्साइड (Ag₂O) आम्हाला सिल्व्हर (Ag) आणि ऑक्सिजन (O₂) देते.
इ.2Mg + O2 → 2MgO
(उत्तर). ही रासायनिक अभिक्रिया ऑक्सिडीकरण प्रक्रिया आहे. या अभिक्रियेत मॅग्नेशियम (Mg) ऑक्सिडीकृत होते आणि मॅग्नेशियम ऑक्साइड (MgO) तयार होते.
ई.. NiO + H2 → Ni + H2O
(उत्तर). या रासायनिक अभिक्रियेत दोन प्रक्रिया घडतात:
१. NiO चे अपचयन: NiO (निकेल ऑक्साइड) हायड्रोजन (H₂) सोबत प्रतिक्रिया करून निकेल (Ni) मध्ये अपचयित होते.
२. H2 चा ऑक्सिडीकरण: हायड्रोजन (H₂) पाण्यात (H₂O) ऑक्सिडीकृत होते.
7. पुढील रासायनिक समीकरणे पायरीपायरीने संतुलित करा
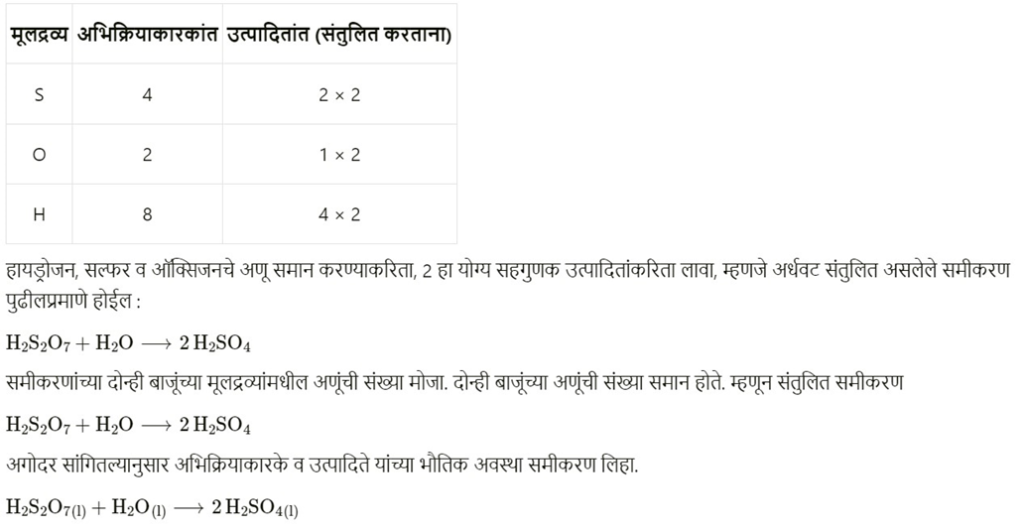
अ. H 2 S 2 O 7 (l) + H2 O(l) H 2 SO 4 (l)
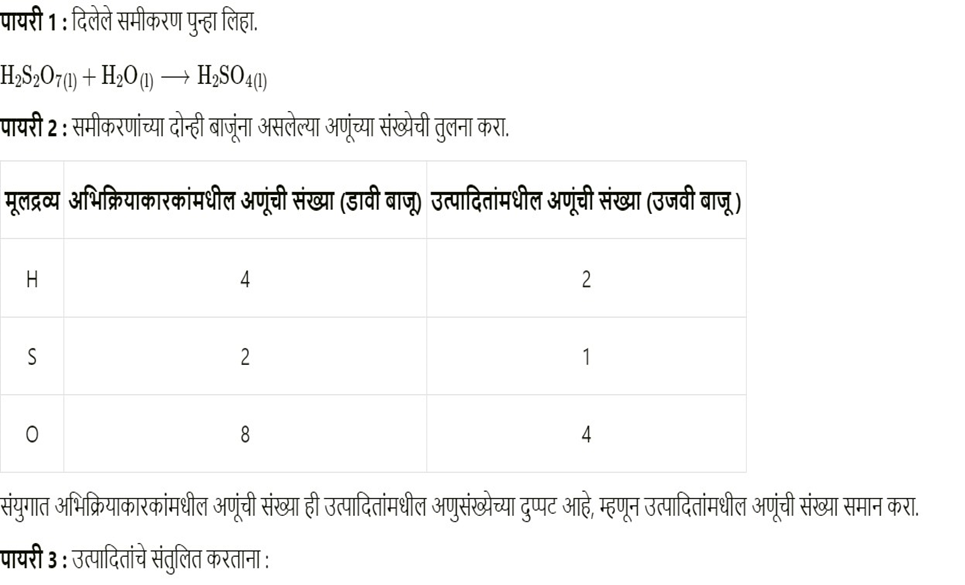
आ. SO 2 (g) + H2 S(aq) S(s) + H2 O (l)
रासायनिक समीकरण संतुलन SO₂(g) + H₂S(aq) → S(s) + H₂O(l)
पायरी १: दिलेले समीकरण लिहा:
SO₂(g) + H₂S(aq) → S(s) + H₂O(l)
पायरी २: प्रत्येक घटकांच्या अणूंची संख्या मोजा:
| घटक | अभिकारक बाजू | उत्पादन बाजू |
| सल्फर (S) | 1 | 1 |
| ऑक्सिजन (O) | 2 | 1 |
| हायड्रोजन (H) | 2 | 2 |
पायरी ३: अणूंची संख्या समान करणे:
- हायड्रोजन (H): दोन्ही बाजूंवर हायड्रोजनची संख्या समान (2) आहे.
- ऑक्सिजन (O): उत्पादन बाजूला ऑक्सिजनची संख्या कमी आहे. उत्पादनात H₂O एका H₂O молекуलाऐवजी 2H₂O (दोन पाण्याचे अणू) बनवून ऑक्सिजनची संख्या 2 पर्यंत वाढवू.
- सल्फर (S): दोन्ही बाजूंवर सल्फरची संख्या समान (1) आहे.
पायरी ४: अंतिम संतुलित समीकरण:
SO₂(g) + 2H₂S(aq) → S(s) + 2H₂O(l)
पायरी ५: भौतिक अवस्था दर्शवा:
SO₂(g) + 2H₂S(aq) → S(s) + 2H₂O(l)
स्पष्टीकरण:
- हायड्रोजन (H): H₂S मध्ये 2H आहेत, त्यामुळे H₂O मध्ये 2H असावेत.
- ऑक्सिजन (O): SO₂ मध्ये 2O आहेत, H₂O मध्ये 1O आहे, म्हणून 2H₂O मध्ये 2O असतील.
- सल्फर (S): SO₂ मध्ये 1S आहे, S मध्ये 1S आहे, म्हणून S ची संख्या समान आहे.
या प्रक्रियेमध्ये, आपण प्रत्येक घटकाच्या अणूंची संख्या दोन्ही बाजूंवर समान करून रासायनिक समीकरण संतुलित केले.
इ. Ag(s) + HCl(aq) AgCl + H 2
पायरी १: दिलेले समीकरण लिहा:
Ag(s) + HCl(aq) → AgCl(s) + H₂(g)
पायरी २: प्रत्येक घटकांच्या अणूंची संख्या मोजा:
| घटक | अभिकारक बाजू | उत्पादन बाजू |
| चांदी (Ag) | 1 | 1 |
| हायड्रोजन (H) | 1 | 2 |
| क्लोरीन (Cl) | 1 | 1 |
ई. NaOH (aq) + H2 SO 4 (aq) Na 2 SO 4 (aq) + H2 O(l)
पायरी १: दिलेले समीकरण लिहा:
NaOH(aq) + H₂SO₄(aq) → Na₂SO₄(aq) + H₂O(l)
पायरी २: प्रत्येक घटकांच्या अणूंची संख्या मोजा:
| घटक | अभिकारक बाजू | उत्पादन बाजू |
| सोडियम (Na) | 1 | 2 |
| हायड्रोजन (H) | 2 | 2 |
| ऑक्सिजन (O) | 4 | 4 |
| सल्फर (S) | 1 | 1 |
पायरी ३: अणूंची संख्या समान करणे:
- सोडियम (Na):
- Na₂SO₄ मध्ये 2Na आहेत, NaOH मध्ये 1Na आहे.
- NaOH च्या गुणाकाराने 2 ला 1 ला बदलू शकत नाही.
- हायड्रोजन (H):
- H₂O मध्ये 2H आहेत, H₂SO₄ मध्ये 2H आहेत.
- दोन्ही बाजूंवर H ची संख्या समान आहे.
- ऑक्सिजन (O):
- H₂O मध्ये 1O आहे, H₂SO₄ मध्ये 4O आहेत.
- H₂O च्या गुणाकाराने 4 ला 1 ला बदलू शकत नाही.
- सल्फर (S):
- Na₂SO₄ मध्ये 1S आहे, H₂SO₄ मध्ये 1S आहे.
- दोन्ही बाजूंवर S ची संख्या समान आहे.
या समीकरणात, सोडियमची संख्या संतुलित करता येत नाही.
पायरी ४: संतुलित समीकरण:
NaOH(aq) + H₂SO₄(aq) → Na₂SO₄(aq) + H₂O(l) (संतुलित नाही)
स्पष्टीकरण:
- H, O आणि S मध्ये दोन्ही बाजूंवर अणूंची संख्या समान आहे.
- Na मध्ये दोन्ही बाजूंवर अणूंची संख्या भिन्न आहे.
- NaOH मध्ये गुणाकार बदलून Na ची संख्या 2 ला 1 ला बदलू शकत नाही.
निष्कर्ष:
हे समीकरण संतुलित करणे अशक्य आहे कारण अभिकारक आणि उत्पादनांमधील सोडियमची संख्या भिन्न आहे.
8. खालील रासायनिक अभिक्रिया ऊष्माग्राही आहेत का ऊष्मादायी आहेत ते ओळखा.
अ. HCl + NaOH → NaCl + H 2 O + उष्णता
हे समीकरण ऊष्मादायी आहे.
स्पष्टीकरण:
- ऊष्मादायी अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊष्णतेची आवश्यकता असते.
- ऊष्माग्राही अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊर्जा बाहेर टाकली जाते.
या समीकरणात, उष्णता (ऊर्जा) उत्पादनांमध्ये एका स्वतंत्र घटकाप्रमाणे दर्शविली जाते. हे दर्शवते की अभिक्रिया पूर्ण होण्यासाठी ऊर्जा बाहेर टाकली जाते.
त्यामुळे, हे समीकरण ऊष्मादायी आहे.
आ.2KClO3(s)⟶ 2KCl(s)+3O2↑
हे समीकरण ऊष्मादायी आहे.
स्पष्टीकरण:
- ऊष्मादायी अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊर्जा बाहेर टाकली जाते.
- ऊष्माग्राही अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊष्णतेची आवश्यकता असते.
या समीकरणात, 3O₂(g) हे उत्पादन आहे. ऑक्सिजन (O₂) हा वायू आहे आणि वायूंमध्ये ऊष्मा ऊर्जा साठवण्याची क्षमता असते. त्यामुळे, KClO₃ मधील रासायनिक बंध मोडून O₂ तयार होत असताना ऊर्जा बाहेर टाकली जाते
CaO + H2O → Ca(OH)2 + उष्णता
खालील रासायनिक अभिक्रिया ऊष्मादायी आहे.
स्पष्टीकरण:
- ऊष्मादायी अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊर्जा बाहेर टाकली जाते.
- ऊष्माग्राही अभिक्रिया: ही अशी रासायनिक अभिक्रिया आहे ज्यामध्ये अभिक्रिया पूर्ण होण्यासाठी ऊष्णतेची आवश्यकता असते.
या समीकरणात, उष्णता (ऊर्जा) उत्पादनांमध्ये एका स्वतंत्र घटकाप्रमाणे दर्शविली जाते. हे दर्शवते की अभिक्रिया पूर्ण होण्यासाठी ऊर्जा बाहेर टाकली जाते.त्यामुळे, हे समीकरण ऊष्मादायी आहे.
CaCO3 (s) ⟶ CaO(s) + CO2 ↑
ऊष्मादायी अभिक्रिया